Atenção
Fechar
O cromo é, de fato, o elemento mais importante e quando usado em elevados teores – acima de 10% - é o mais eficiente de todos, na maioria das condições, embora os aços ao cromo e ao cromo-níquel não sejam resistentes em certos meios, como ácido clorídrico.
Parece que nenhum dos elementos citados, a sós ou combinados, em teores abaixo de 1% retarda materialmente a corrosão, com exceção do cobre que já em teores de 0,2% retarda definitivamente a corrosão atmosférica melhorando a resistência dos aços à corrosão atmosférica de três a cinco vezes em relação aos aços sem cobre.
De qualquer modo, o cromo é o elemento essencial, podendo-se dizer que a ciência dos aços inoxidáveis é a ciência do cromo como elemento de liga no ferro.
O papel do cromo como elemento protetor à corrosão está ilustrado no gráfico da figura 155, onde se observa que, numa atmosfera industrial, o aço, à medida que o seu teor em cromo aumenta, passa de um metal de grande corrosibilidade a um metal praticamente indestrutível pela corrosão.
A temperaturas elevadas, nota-se também o mesmo fato, isto é, à medida que aumenta o teor de cromo, diminui a tendência à oxidação. Passa-se assim dos aços simplesmente inoxidáveis aos aços resistentes ao calor, que serão objeto de estudo posteriormente e que se caracterizam por apresentarem não só resistência à oxidação a elevadas temperaturas de serviço, como também razoável resistência mecânica nessas temperaturas.
O gráfico da figura 156 ilustra o efeito do cromo na resistência do aço à oxidação a altas temperaturas. Verifica-se que o efeito mais positivo do cromo, neste caso, só se desenvolve quando o seu teor está acima de 20%.
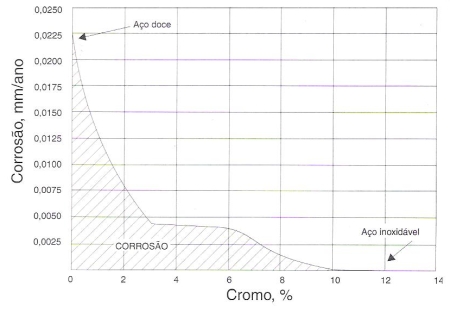
Fig. 155 – Gráfico ilustrando a passividade dos aços-cromo expostos durante 10 anos a uma atmosfera industrial.
O gráfico da figura 157 ilustra o fenômeno da passividade medido pela velocidade de ataque de ligas Fe-Cr por ácido nítrico a 33%. As três curvas representam ensaios a três temperaturas diferentes. Enquanto é mais difícil resistir a ácido quente, a velocidade do ataque químico a qualquer temperatura cai repentinamente a valor praticamente desprezível quando o teor de cromo excede 12%.
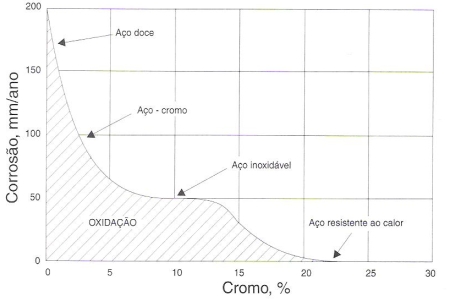
Fig. 156 – Gráfico ilustrando o efeito do cromo na resistência dos aços à oxidação a altas temperaturas. A curva mostra a penetração da oxidação em cubos de ½” aquecidos durante 48 horas a 1000 graus C no ar.
Em resumo:
- o cromo é capaz de assegurar-se o oxigênio para manter uma camada impermeável de oxigênio ou de óxido, a qual é extremamente estável;
- esta camada, embora invisível, é contínua e, em meios oxidantes, possui uma pressão de solução tão baixa que concede ao metal um comportamento nobre;
- esta propriedade do cromo é possuída também por certas de suas ligas com o ferro;
- a película Cr-O é, entretanto, removida pela HCl e o metal, uma vez desprovido da película protetora é menos nobre que o ferro.
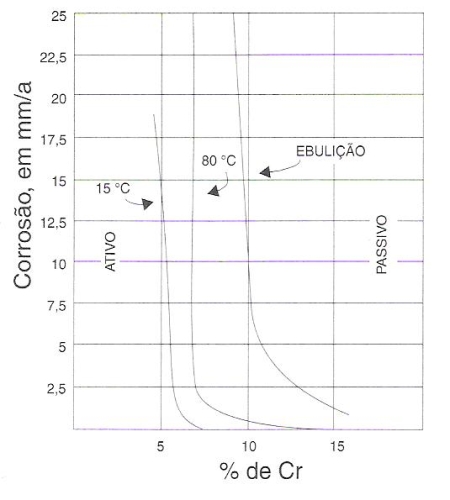
Fig. 157 – Gráfico ilustrando o fenômeno da passividade medido pela velocidade de ataque de ligas ferro-cromo por ácido nítrico a 33%.